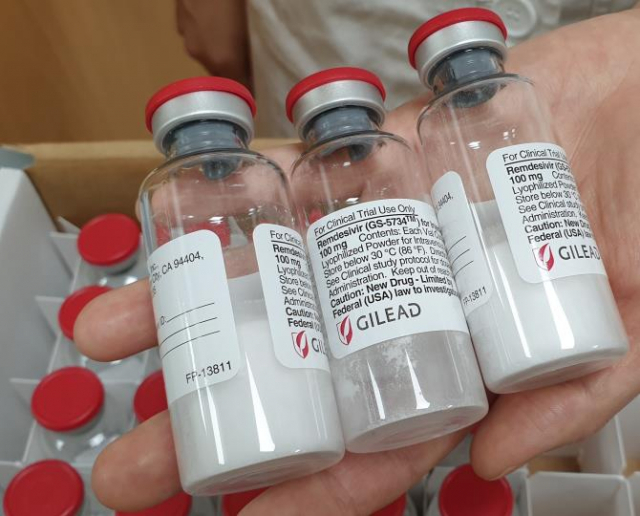
식품의약품안전처가 신종 코로나바이러스 감염증(코로나19) 치료제 렘데시비르의 임상 중 부작용을 인지했지만 치료제 사용을 허가했다는 주장이 제기됐다.
28일 국회 보건복지위원회 소속 강기윤 국민의힘 의원이 식약처에서 받은 자료에 따르면 식약처는 지난 4월 렘데시비르 임상에서 지난 4월 '심박수 감소' 부작용 1건을 보고 받았지만 7월 24일 치료제 사용을 허가했다. 앞서 식약처는 지난 3월 27일부터 6월 25일까지 서울 의료원에서 임상을 실시했다.
식약처는 특례수입 제도를 통해 렘데시비르를 국내 공급했고, 지난 7월 사용을 허가했다. 특례 수입이란 품목 허가 없이도 긴급히 도입해 치료에 사용하려는 제도다. 당시 식약처는 코로나19 장기화에 따라 안정적인 물량 확보를 위해 품목 허가를 결정한다고 밝힌 바 있다.
렘데시비르는 에볼라 치료제로 개발한 항바이러스제로, 길리어드사이언스에서 제작했다. 앞서 미국 국립보건원 주도로 시행된 임상시험에서 코로나19 중증 환자 회복 기간을 약 4일 31% 감소한 효과를 보인 바 있다.
그러나 중앙방역대책본부는 지난 7일까지 렘데시비르를 투약받은 환자 274명 중 16명이 사망했다고 발표했다. 지난 8월 방역당국은 렘데시비르를 투여받은 코로나19 환자에게서 이상 반응을 확인했다. 주요 부작용 증상은 간 수치 상승, 피부 두드러기 및 발진, 심장 심실 조기수축 등이었다. 하지만 렘데시비르 투약이 정확히 어떤 효과가 있는지, 부작용이 나타나는 이유 등에 대해서는 정확히 파악하지 못하고 있다.
강 의원은 "부작용이 없는 약은 없겠지만, 국내 임상에서 부작용이 발생했다면 코로나19로 전 국민이 엄중한 위기에 놓여있는 현실을 고려해 사실을 투명하게 공개했어야 한다"며 "코로나19 중증환자 중 고령자가 심혈관 기저질환이 있을 경우 이상 반응이 발생할 수도 있기 때문에 추가적인 연구와 검증이 필요하다"고 말했다.
























댓글 많은 뉴스
이재명 90% 득표율에 "완전히 이재명당 전락" 국힘 맹비난
권영세 "이재명 압도적 득표율, 독재국가 선거 떠올라"
[우리 아기가 태어났어요]신세계병원 덕담
"하루 32톤 사용"…윤 전 대통령 관저 수돗물 논란, 진실은?
'이재명 선거법' 전원합의체, 이례적 속도에…민주 "걱정된다"