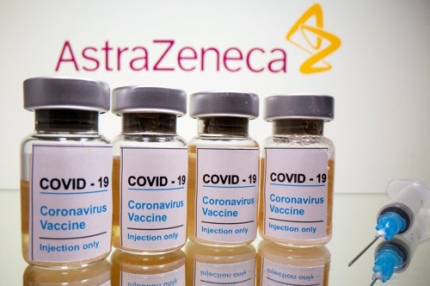
미국 식품의약국(FDA)가 아스트라제네카 백신의 긴급사용 승인을 두 달 늦췄다.
도널드 트럼프 행정부의 코로나19 백신 프로젝트인 '초고속 작전'의 몬세프 슬라위 최고과학자는 이날 기자회견에서 "모든 것이 잘 됐을 때 4월 초께 가능할 것"이라고 말했다.
아스트라제네카는 백신 개발과정에서 줄곧 선두로 달려왔지만 3상 임상시험 초기 결과를 둘러싸고 FDA가 문제를 제기하면서 긴급사용 승인이 지연되고 있다.
뉴욕타임스(NYT)는 FDA와 아스트라제네카 사이에 신뢰가 손상된 게 아니냐는 분석을 하기도 했다.
미국 FDA 관계자는 "아스트라제네카 백신이 중증 질환에는 효과적인 것으로 보이지만, 임상시험 초기에는 노인 참가자를 거의 찾아볼 수 없었다"며 "고령자에 대한 예방 효과가 사실상 알려지지 않았다"고 했다.
그러면서 "이 바이러스가 노인에게 미치는 영향을 고려하면 이 회사 백신을 향한 가장 큰 의문이 여전히 남는다"고 덧붙였다.
현재까지 아스트라제네카의 미국 내 3상 임상시험에 2만9000여명이 등록했고, 참가자 모집이 거의 마무리됐다고 슬라위 최고책임자는 밝혔다. 미국 정부는 아스트라제네카 백신 3억 회 투여분을 주문해놓은 상태다.
한편 한국정부는 아스트라제네카와 1000만명 분의 공급 계약을 체결하고 내년 2월에서 3일 사이 국내에 도입할 계획을 갖고 있다.





![[단독] '월남전 유공자 명의 입당원서 위조' 조성은 증거 보니](https://www.imaeil.com/photos/2025/03/13/20250313105205121741830725_l.jpg)





















댓글 많은 뉴스
국힘 김상욱 "尹 탄핵 기각되면 죽을 때까지 단식"
[단독] 경주에 근무했던 일부 기관장들 경주신라CC에서 부킹·그린피 '특혜 라운딩'
[정진호의 매일내일(每日來日)] 3·1절에 돌아보는 극우 기독교 출현 연대기
민주 "이재명 암살 계획 제보…신변보호 요청 검토"
김세환 "아들 잘 부탁"…선관위, 면접위원까지 교체했다