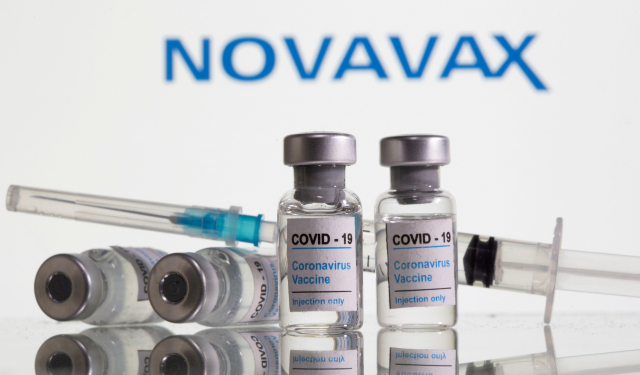
미국 제약사 노바백스가 자사 개발 코로나19 백신의 미 식품의약국(FDA) 긴급사용 승인 신청 계획을 또 다시 연기했다.
월스트리트저널 등은 5일(현지시간) 미국 제약사 노바백스가 FDA에 자사 개발 코로나19 백신의 긴급사용 승인 신청 일정을 올해 3분기에서 4분기로 미뤘다고 보도했다.
스탠리 어크 노바백스 최고경영자(CEO)는 "승인 관련 작업을 마무리하는 정도의 문제"라며 지연 이유를 설명했다.
노바백스가 개발한 'NVX-CoV2373' 백신은 대규모 임상시험에서 90%의 높은 예방효과를 보였다.
그러나 노바백스는 백신 사용승인 신청과 생산 확대 일정을 거듭해서 연기하고 있다고 로이터는 지적했다.
이 회사는 현재 인도, 인도네시아, 필리핀 등 다른 나라들에서 먼저 백신 사용 승인을 신청한 상태다.
세계보건기구(WHO)에는 이달 중으로 긴급사용 승인을 신청할 것으로 전망된다. 코로나19백신 국제 공동구매 프로젝트인 코백스(COVAX) 참가국들에 백신을 수출하려면 WHO의 긴급 승인이 필요하다.
오는 9월에는 영국에서, 호주와 캐나다에서는 수 주 내로 각각 자사 백신의 긴급사용 허가를 신청할 계획이라고 어크 CEO는 전했다.
노바백스는 또 2회 접종을 마친 지 6개월 뒤 추가로 1회 투여하는 백신 부스터샷이 항체를 4.6배 증가시키는 것으로 나타났다고 밝혔다.
이 회사는 올해 3분기까지 월 1억회분, 4분기에는 월 1억5천만회분의 백신을 각각 제조할 계획이다.
어크 CEO는 "공급상의 문제를 극복한 것으로 보인다"며 "이제 대량 생산할 수 있을 것"이라고 말했다.
노바백스 백신은 한국도 4천만회분을 확보한 상태다. 구체적인 국내 공급 일정은 아직 확정되지 않았다.
식품의약품안전처는 지난 4월 29일 노바백스 백신의 국내 생산과 허가를 맡은 SK바이오사이언스의 신청을 받아 3개월째 백신 안전성 등에 관한 사전검토를 하고 있다. 사전검토는 제약사가 백신을 정식으로 허가 신청하기 전 식약처에 품질, 비임상, 임상 등 자료를 제출해 허가신청 후 심사에 걸리는 시간을 단축할 수 있도록 하는 절차다.



























댓글 많은 뉴스
"TK신공항, 전북 전주에 밀렸다"…국토위 파행, 여야 대치에 '영호남' 소환
헌재, 감사원장·검사 탄핵 '전원일치' 기각…尹 사건 가늠자 될까
구미 '탄반 집회' 뜨거운 열기…전한길 "민주당, 삼족 멸할 범죄 저질러"
계명대에서도 울려펴진 '탄핵 반대' 목소리…"국가 존립 위기 맞았다"
尹 대통령 탄핵 심판 선고 임박…여의도 가득 메운 '탄핵 반대' 목소리